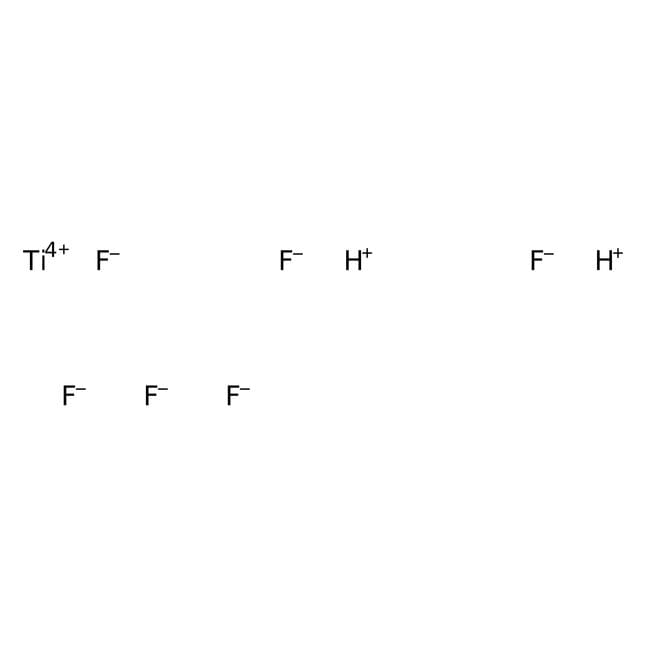
L’acide hexafluorotitanique, ou simplement acide fluorotitanique, est un composé chimique de formule théorique H2TiF6. Il est distribué commercialement en solution aqueuse, généralement à une concentration de 60 % en masse,. Il existe également sous forme d'hydrates H2TiF6·nH2O, avec n = 4, 6, et probablement 10. Le tétrahydrate (n = 4) et l'hexahydrate (n = 6) ont chacun un point de fusion congruent à −12 et 0 °C. Le décahydrate (n = 10) se décompose à −79 °C en hexahydrate et en glace. Le tétrahydrate connaît une transition de phase à −57 °C. La cristallographie aux rayons X à partir des monocristaux obtenus de l'hexahydrate a permis de déterminer la présence des cations H3O et H5O2 coordonnés à des anions [TiF6]2−. L'hexahydrate H2TiF6·6H2O est isomorphe à celui d'acide hexafluorosilicique H2SiF6·6H2O.
L'acide hexafluorotitanique peut être préparé en dissolvant du dioxyde de titane TiO2 dans de l'acide fluorhydrique HF, :
- TiO2 6 HF ⟶ H2TiF6 2 H2O.
Il peut également être préparé en faisant réagir du titane métallique avec HF :
- Ti 6 HF ⟶ H2TiF6 2 H2.
Il forme des sels avec divers cations, comme l'hexafluorotitanate de potassium K2TiF6.
Notes et références
- Portail de la chimie