L'équation de Sackur-Tetrode, établie en 1912 par les physiciens Otto Sackur et Hugo Tetrode,, donne l'entropie d'un gaz parfait monoatomique, non dégénéré, non relativiste.
Soit la longueur d'onde thermique de de Broglie : , et le volume correspondant.
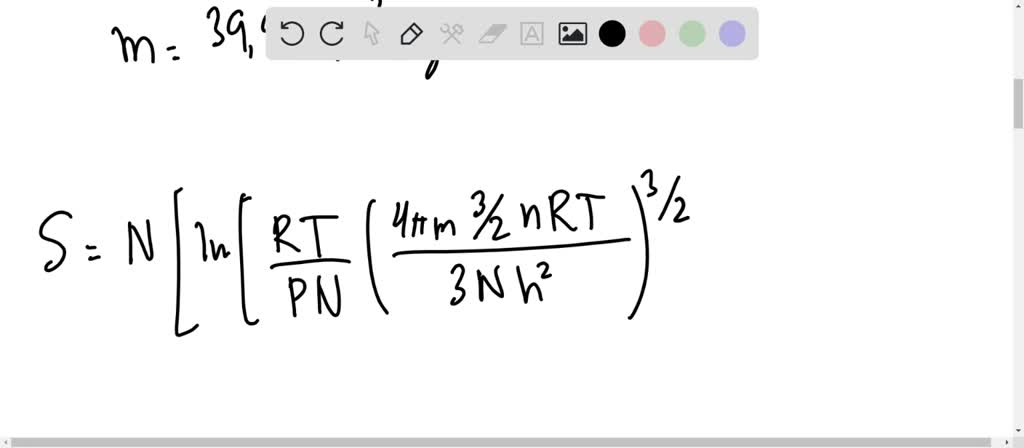
Alors, l'entropie S = S(U,V,N) du gaz (défini par son volume V, son énergie interne U et son nombre de particules N) vaut :
soit en développant :
- .
Les expressions ci-dessus supposent que le gaz est dans le régime classique et est décrit par la statistique de Maxwell-Boltzmann (avec le "décompte correct de Boltzmann"). D'après la définition de la longueur d'onde thermique, cela signifie que l'équation de Sackur-Tetrode est valable uniquement quand :
L'entropie prédite par l'équation de Sackur-Tetrode tend vers moins l'infini quand la température tend vers zéro.
En chimie, on préfère parfois retenir plutôt l'enthalpie libre G = U NkT -TS = -NkT. Ln P/P(T) avec P(T) = kT/Vo :
G =-RT.LnP cste(T) est le fondement de la loi d'action de masse :
on obtient ainsi les ordres de grandeur des constantes d'équilibre Kp(T) des réactions.
Constante de Sackur-Tetrode
La constante de Sackur–Tetrode, écrite S0/R, est égale à S/kBN évaluée à la température de T = 1 kelvin, à la pression standard (100 kPa ou 101,325 kPa, à préciser), pour une mole d'un gaz idéal composé de particules de masse égale à l'unité de masse atomique unifiée (mu = 1,66053906660(50)×10−27 kg). Sa valeur recommandée par CODATA 2018 est :
- S0/R = −1,151 707 537 06 ± (45) pour p
o= 100 kPa - S0/R = −1,164 870 523 58 ± (45) pour p
o= 101,325 kPa.
Gaz rares
En chimie, on donne l'entropie molaire standard dans les conditions standard (25 °C, P = 1 × 105 Pa).
Le calcul pour m = 40 u donne 154,8 J/K/mol
Les valeurs de l'entropie molaire standard S° (en J K-1 mol-1) données par CODATA sont :
- Hélium : M = 4,002602 u - S° = 126,153(2) ;
- Néon : M = 20,1797 u - S° = 146,328(3) ;
- Argon : M = 39,948 u - S° = 154,846(3) ;
- Krypton : M = 83,80 u - S° = 164,085(3) ;
- Xénon : M = 131,29 u - S° = 169,685(3) ;
- Radon : M = 222 u - S° = 176,23.
On pourra vérifier que les données s'accordent pour donner : S° = S°(M=1) 3/2 R.Ln M
avec une assez bonne corrélation à condition de modifier légèrement pour l'hélium la correction de de Boer ; S°(M=1) est même négative, ce qui laisse parfois perplexes certains[Quoi ?], inattentifs à la condition de non-dégénérescence.
En comptant en bit[Quoi ?]/molécule, on retient que pour l'Argon, S° =~ 27 bits/molécule pour M = 40 : évidemment il faut S° assez grand, sinon la dégénérescence quantique doit être évaluée.
Références
Voir aussi
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sackur–Tetrode equation » (voir la liste des auteurs).
Articles connexes
- Principe de Nernst
- Troisième principe de la thermodynamique
- Portail de la chimie
- Portail de la physique